On considère les deux réactions suivantes :
(1) 2 Hg (l) + O2 (g) = 2 HgO (s)
(2) 2 Hg (g) + O2 (g) = 2 HgO (s)
a ) L'enthalpie libre standard de la réaction (1)
est notée ![]() . Etablir son expression littérale.Calculer
. Etablir son expression littérale.Calculer ![]() .Réponse.
.Réponse.
b) Etablir l'expression littérale de ![]() ,
enthalpie libre standard de la réaction (2) . Montrer que l'on
obtient :
,
enthalpie libre standard de la réaction (2) . Montrer que l'on
obtient :
![]() =
- 299,8 + 0,4040 x T (en kJ.mol-1 ). Réponse
.
=
- 299,8 + 0,4040 x T (en kJ.mol-1 ). Réponse
.
c ) Pour
une pression de 1 bar, la droite ![]() =
f (T) coupe l'axe des abscisses en un point M. Déterminer
la température TM . Que représente-t-elle pour la réaction
(2) ?
=
f (T) coupe l'axe des abscisses en un point M. Déterminer
la température TM . Que représente-t-elle pour la réaction
(2) ?
Dans quelles conditions l'obtention du mercure gaz est-elle favorisée
? Réponse.
d) Dans une enceinte de volume constant V = 10,0 L, initialement vide , on introduit 2,0 mol d'oxyde de mercure (II) solide. On porte la température à 480 °C.
Données :
Les gaz sont assimilés à des gaz parfaits. R = 8,31
J.mol-1.K-1.
Mercure : Téb = 357 °C sous 1 bar.
Enthalpie de vaporisation du mercure sous 1 bar : ![]() .
.
Grandeurs thermodynamiques à 298 K sous 1 bar .
|
Composé
|
|
|
| Hg (l) |
-
|
75,9
|
| HgO (s) |
- 90,8
|
70,3
|
| O2 (g) |
-
|
205,2
|
|
|
=
|
|
- T x
|
| Dans le cadre de l'approximation d'Ellingham |
|
et
|
|
|
=
|
2 x - 90,8 = - 181,6 kJ.mol-1 | ||
|
=
|
- 2 x 75,9 - 205,2 +2 x 70,3 = - 216,4 J.mol-1.K-1 |
|
|
=
|
- 181,6 + 0,2164 x T en kJ.mol-1 Enoncé |
(2) 2 Hg (g) + O2 (g) = 2 HgO (s)
Cette réaction peut être obtenue par combinaison
linéaire des réactions suivantes : ![]()
|
(1) 2 Hg (l) + O2 (g) = 2 HgO (s) et (3) Hg (l) = Hg (g) |
|
soit (2) = (1) - 2 x (3) d'où
|
=
|
- 181,6 - 2 x 59,1 = - 299,8 kJ.mol-1 et | |
 |
=
|
- 216,4 - 2 x 59100/630 = - 404,0 J.mol-1.K-1 |
| On en déduit : |
|
= - 299,8 + 0,4040 x T en kJ.mol-1 Enoncé |
c ) La température TM est la température pour laquelle l'enthalpie libre standard de la réaction (2) s'annule : TM est la température d'inversion de la réaction (2).
![]()
d ) La réaction qui se produit est la réaction inverse de la réaction (2) :
(-2) 2 HgO (s) = 2 Hg (g) + O2 (g)
| La constante K(T) s'exprime : | 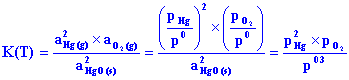 |
puisque aHgO (s) = 1 |
| La valeur de K(T) se déduit de : |
|
d'où
|
| A.N.: |
Remarque ; la valeur ainsi déterminée est cohérente avec la réponse à la question c : la valeur de la constante est en effet supérieure à l'unité et l'équilibre est en faveur du mercure ce qui est cohérent avec la valeur de la la température (753 K) supérieure à TM .
On écrit le bilan de matière de la réaction ; la valeur du taux de dissociation a étant demandée , on exprime le nombre de moles de chacune des espèces en fonction de a : on rappelle que ;
|
|
d'où
|
n HgO dissocié = n0, HgO x a = 2,0 x a |
|
2 HgO (s)
|
=
|
2 Hg (g)
|
+
|
O2 (g)
|
n g
|
|
| E.I. (mol) |
2,0
|
-
|
-
|
0 (HgO n'est |
||
| équi. (mol) |
2,0 x (1-a
)
|
|
2a
|
|
a
|
3a
|
| fractions molaires |
1
|
|
2/3
|
|
1/3
|
En reprenant l'expression de la constante K(T), il vient ;
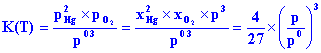 |
d'où
|
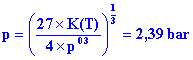 |
La valeur du taux de dissociation se déduit du nombre total
de moles de gaz (3a ) calculé en appliquant
l'équation d'état des gaz parfaits: pV = 3a
xRT d'où
a = 0,127 soit 12,7%.Enoncé