|
|
et |
|
Tracé et exploitation du diagramme logarithmique de concentration d'un monoacide.
Td diagramme logarithmique d'un diacide.
L'applet Java ci-dessous illustre un diagramme logarithmique. Vous pouvez, en utilisant les zones de saisie adéquates changer le couple acide base ou la concentrationLe bon fonctionnement de cet Applet Java peut nÚcessiter de tÚlÚcharger le plug-in Java disponible Ó l'adresse suivante http://java.sun.com/getjava/installer.html
Voir le code source de l'applet .
1) Introduction.
Le principe d'un tel diagramme consiste à représenter le logarithme de la concentration des différentes espèces acido-basiques présentes dans une solution en fonction du pH .
Ainsi le diagramme logarithmique d'une solution d'acide éthanoïque comporte les courbes Log[H3O+]=f(pH), Log[OH-]=f(pH), Log[CH3COOH]=f(pH) et Log[CH3COO-]=f(pH).
2) Tracé du diagramme.
Nous nous proposons de tracer le diagramme logarithmique d'une solution d'acide éthanoïque de concentration initiale C0; il est nécessaire, pour cela, d'établir les expressions de [CH3COOH] et de [CH3COO-] en fonction de C0, Ka et [H3O+] ou h.
Question 1 ; écrire l'équation de conservation de la matière et donner l'expression de la constante d'acidité.
Question 2 ; en utilisant les deux relations précédentes établir les expressions suivantes ;
|
|
et |
|

Question 3 ; identifier sur le graphique la courbe correspondant à chacune des espèces.
3)Exploitation du diagramme
3.1) Diagramme de prédominance
Question 4 ; comment peut-on déduire ou vérifier à partir de ce graphique la valeur du pKa du couple CH3COOH/CH3COO- ?
Question 5 ; on considère généralement qu'une espèce X est négligeable par rapport à une espèce Y si [X]<[Y]/10 ; en déduire que sur le diagramme logarithmique, à un pH donné ,l'espèce X est négligeable par rapport à l'espèce Y si Log[Y]-Log[X]>1.
Question 6 ; en appliquant le critère précédent, préciser les domaines de prédominance respectifs de CH3COOH et CH3COO- .
3.2) Détermination du pH d'une solution de l'acide faible.
On se propose de déterminer graphiquement le pH d'une solution d'acide éthanoïque de concentration C0=0,100mol.L-1.
Question 7 ; écrire les différentes réactions acide-base possibles ; calculer leur constante et en déduire la réaction prépondérante.
Question 8 ; en ne tenant compte que de la réaction
d'hydrolyse de l'acide faible, on obtient la relation
[CH3COO-]=[H3O+] ; utiliser
cette relation pour déterminer graphiquement le pH.Voir
le principe de la détermination
Question 9 ; montrer, à l'aide du graphique, que l'approximation consistant à négliger l'autoprotolyse de l'eau est valide.
Question 10 ; déterminer de la même manière
le pH d'une solution d'acide éthanoïque de concentration C0=1,00.10-4mol.L-1
puis le pH d'une solution d'ions ammonium NH4+ de concentration
C0=1,00.10-4mol.L-1 ; vérifier
dans chaque cas la validité de l'approximation.
3.3) Détermination du pH d'une solution de la base faible.
On se propose de déterminer graphiquement le pH d'une solution d'éthanoate de sodium de concentration C0=0,100mol.L-1.
Question 11 ; en reprenant la démarche suivie pour l'acide faible, déterminer graphiquement le pH de la solution d'éthanoate de sodium ; vérifier la validité de l'approximation consistant à négliger la réaction d'autoprotolyse de l'eau.
Question 12 ; répondre à la même question pour une solution d'éthanoate de sodium de concentration C0=1,00.10-4mol.L-1.
Diagramme logarithmique d'un diacide.
TD diagramme logarithmique d'un monoacide.
Nous nous proposons de tracer le diagramme logarithmique d'une solution d'acide éthanedioïque HOOC-COOH.
Ce diagramme doit comporter les courbes Log[H3O+], Log[OH-], Log[H2C2O4], Log[HC2O4-] et log[C2O42-] en fonction du pH.
1 )Tracé du diagramme.
Question 1 ; écrire l'équation de conservation de la matière de CO2 et donner l'expression des constantes d'acidité Ka1 et Ka2.
Question 2 ; établir, en utilisant les relations précédentes , les expressions suivantes ;
 ,
,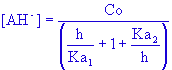 ,
,
2 ) Exemple
a) Objectif.
Nous voulons calculer le pH d'une solution d'hydrogénoéthanedioate de sodium NaHC2O4 de concentration C0. On donne pour l' acide éthanedioïque (acide oxalique) pKa1= 1,2 ; pKa2 = 4,3.
b) Application.
Question 3 : Ecrire l'équation de dissolution de NaHC2O4.
Question 4 : Ecrire les différentes réactions acide-base possibles et calculer leur constante. En déduire la ou les réactions prépondérantes.
Question 5 : Etablir la formule permettant de calculer le pH de la solution d'hydrogénoéthanedioate de sodium en ne tenant compte que de la réaction prépondérante ; effectuer le calcul pour les concentrations suivantes : C0 = 1,00 mol.L-1 et C0=1,00.10-2 mol.L-1 . Préciser, en examinant les réactions non prépondérantes, dans quelles conditions les résultats obtenus sont valides.
Question 6 : Afin de vérifier la validité des approximations faites, tracer le diagramme logarithmique de concentrations de NaHC2O4.
Question 7 : Expliquer comment il est possible, en utilisant le bilan de la réaction prépondérante déterminée à la question 2, d'obtenir graphiquement le pH.
Question 8: Vérifier dans les deux cas la validité des approximations formulées.
Question 9 : Dans l'un des deux cas, les approximations ne sont pas valides ; préciser de quelle réaction supplémentaire il est nécessaire de tenir compte.
Question 10 : Déduire des deux réactions, une relation entre [H2C2O4], [C2O42-] et [H3O+]. Quelle courbe est-il nécessaire de tracer pour déterminer graphiquement le pH ? Tracer cette courbe ; déterminer le pH puis conclure.