Déplacer le pointeur de la souris sur les boutons ci-dessus.
Etude thermodynamique de l'équilibre de dissociation de l'ammoniac
 |
|
Déplacer le pointeur de la souris sur les boutons ci-dessus. |
 |
|
1 ) Calculer l'enthalpie et l'entropie standard de la réaction à 298 K. Commenter les signes obtenus.
2 ) Calculer l'enthalpie libre standard de réaction ![]() à
298 K. Commenter le signe obtenu.
à
298 K. Commenter le signe obtenu.
3) Le graphe 1, donné ci-dessous, est la représentation graphique
de la courbe ![]() =
f(T) pour une pression P de 1bar ; on constate que cette courbe coupe l'axe
des abscisses en un point M d'abscisse TM = 458 K.
=
f(T) pour une pression P de 1bar ; on constate que cette courbe coupe l'axe
des abscisses en un point M d'abscisse TM = 458 K.
4 ) On donne la valeur, à 470 K, de l'enthalpie libre standard![]() = -2,53 kJ.mol-1. Donner l'expression de la constante d'équilibre Kp relative
aux pressions partielles. Calculer la valeur de Kp à 470 K.
= -2,53 kJ.mol-1. Donner l'expression de la constante d'équilibre Kp relative
aux pressions partielles. Calculer la valeur de Kp à 470 K.
5) On réalise à 470 K sous une pression totale constante P = 1,0 bar la dissociation d'une mole d'ammoniac.
On rappelle que l'avancement x de la réaction à un instant t est tel que ;
Vérifier que la valeur de l'avancement x, à l'équilibre, est 0,36 mol.
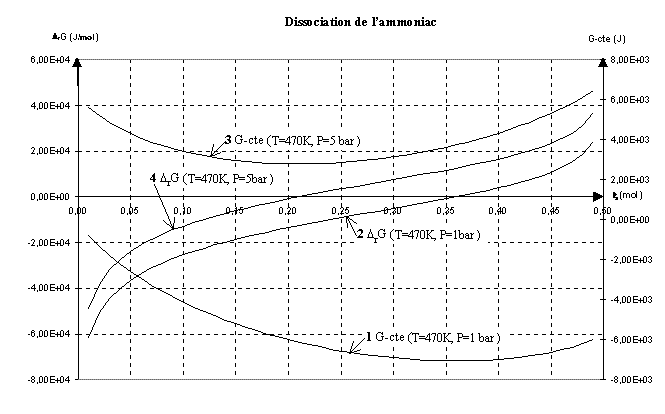
6) On considère toujours la dissociation , à 470K d'une mole d'ammoniac ;sur le graphe 2 ci-dessous, sont données,
Expliquer comment les courbes 1 et 2 permettent de vérifier la valeur de l'avancement à l'équilibre donnée à la question 1.5.
Déterminer graphiquement l'avancement à l'équilibre pour T=470 K et P = 5 bar ; que peut-on en conclure sur l'effet d'une augmentation de la pression sur la dissociation de l'ammoniac ; ce résultat était-il prévisible ?

Graphe 1 ; courbe ![]() =
f(T).
=
f(T).